Caso Clínico
Disgerminoma puro de ovario gigante en paciente joven de 19 años
1Estudiante, Facultad de Medicina, Universidad Nacional de Trujillo, La Libertad, Perú. Miembro Sociedad Científica Estudiantes de Medicina, Universidad Nacional de Trujillo, Libertad, Perú.
2Estudiante, Facultad de Medicina, Universidad Continental, Huancayo, Junín, Perú. Miembro Sociedad Científica Médico Estudiantil Continental.
3Estudiante, Facultad de Medicina, Universidad Peruana Los Andes, Huancayo, Junín, Perú. Miembro Sociedad Científica Peruana los Andes.
4Médico Especialista en Cirugía Oncológica, Médico Asistente, Instituto Regional de Enfermedades Neoplásicas Centro, Concepción, Junín, Perú.
5Médico Especialista en Patología Clínica, Médico Asistente Instituto Regional de Enfermedades Neoplásicas Centro, Concepción, Junín, Perú.
El disgerminoma de ovario es una neoplasia muy infrecuente. Se presenta mayormente en mujeres jóvenes con manifestaciones clínicas inespecíficas, aunque pueden señalar dolor abdominal, sensación de masa y alteraciones menstruales. Se comunica el caso de una paciente joven de 19 años multípara con sensación de masa intraabdominal, de crecimiento progresivo y asociado a dolor de tipo opresivo. En el examen tomográfico se encontró una masa anexial dependiente de ovario, por lo que se le practicó una anexectomía derecha y biopsia por congelación más estadiaje. La evaluación macroscópica evidenció una tumoración de 25 x 20 x 13 cm, que pesaba 5,760 gramos. Mediante evaluación microscópica y estudios de inmunohistoquímica se la diagnosticó como disgerminoma puro. En base al tamaño promedio y antecedentes, fue catalogada como disgerminoma gigante.
Palabras clave: Ovario; Neoplasias ováricas; Disgerminoma
INTRODUCCIÓN
El cáncer de ovario (CO) se clasifica por el origen de uno de sus tres principales componentes: epitelio, estroma y células germinales 1). Entre los tumores malignos de células germinales (TMCG) se incluyen: disgerminomas de ovario (DO), teratomas inmaduros, tumores de saco vitelino y mixtos de células germinales 2). Constituyen aproximadamente 0,9 a 2% de todas las neoplasias malignas del ovario 3). Suelen presentarse en pacientes jóvenes y se les diagnostica antes de los 30 años hasta en 85% de los casos 4). La presentación clínica incluye síntomas tardíos como sensación de pesadez en la pelvis, distensión abdominal, dolor abdominal bajo y trastornos menstruales 2).
Su símil en el varón es el seminoma, que se presenta con mayor frecuencia entre los 30 y 45 años. Clínicamente es una masa testicular que evoluciona a partir de una neoplasia in situ de células germinales, progresa a seminoma intratubular en la etapa pospuberal y posteriormente a seminoma invasivo en la edad mediana 5).
En el disgerminoma, los estudios de imagen son imprescindibles para localizar y definir las características de la tumoración 6). Macroscópicamente es de consistencia sólida y bien encapsulada. Microscópicamente se compone de células redondas con infiltrado linfoide separadas por hebras fibrosas 7). Los exámenes de laboratorio no son específicos, pero puede existir elevación de la fosfatasa alcalina (FA), beta gonadotropina coriónica humana (hCG-β), alfa feto proteína (AFP), lactato deshidrogenasa (LDH) y, en algunos casos, el calcio 8). El DO y el seminoma tienen los mismos marcadores inmunohistoquímicos para confirmar el diagnóstico: SALL4, OCT4, CD117 2), fosfatasa alcalina placentaria (PLAP) (2 y D2-40 con una mutación en c-KIT 4). El tratamiento actual consiste en la cirugía conservadora de fertilidad, quimioterapia adyuvante y radiación postoperatoria. La sobrevida en 5 años está entre el 75% y 90% en los estadios tempranos 9).
COMUNICACIÓN DEL CASO
Paciente de 19 años procedente de Huancavelica-Perú, con fórmula obstétrica G2P2002 y tiempo de enfermedad de 1 año, caracterizada por sensación de una masa intraabdominal de crecimiento progresivo asociada a dolor tipo opresivo de moderada intensidad, de curso intermitente. Al examen físico, los signos vitales eran estables. Se evidenció el abdomen globuloso, blando, depresible, no doloroso a la palpación y la presencia de una masa no móvil de 20 x 25 cm, aproximadamente.
Se realizó Papanicolau con biopsia de cérvix, hallándose un carcinoma escamoso in situ con extensión glandular. Al día siguiente se le realizó pruebas de laboratorio y resaltó la elevación de CA-125, LDH y hCG-β (ver tabla 1). Adicionalmente, se le realizó una tomografía computarizada (TC) que evidenció una masa abdominopélvica (figura 1A).
Tabla 1 Valores de laboratorio.

APF: alfa-fetoproteína; LDH: dehidrogenasa láctica
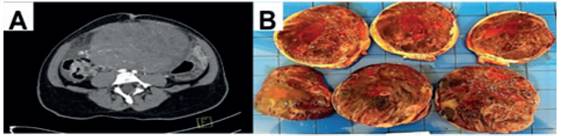
Figura 1 A. Tomografía computarizada (TC) simple y contrastada: en la excavación pelviana se observó una imagen sólida, heterogénea y con aparente dependencia del anexo derecho. Presencia de líquido libre en cavidad peritoneal. B. Aspecto macroscópico: tejido color pardo vinoso hemorrágico.
Se planificó anexectomía derecha con biopsia por congelación más estadiaje conservador. El informe patológico reveló que las dimensiones del tumor eran 25 x 20 x 13 cm, con un peso de 5,760 gramos. Además, presentaba cápsula íntegra, lisa y brillante. A los cortes múltiples se observó tejido firme de aspecto ‘carnoso’, con focos de aspecto gelatinoso. La trompa uterina derecha no tenía alteraciones (figura 1B).
En la descripción microscópica de las láminas evaluadas se identificó nidos de células tumorales con patrón alveolar (figura 2A). Las células tumorales característicamente presentaban abundante citoplasma pálido, núcleo único con nucléolo redondo prominente, rango mitótico de 3 en 10/ CAP (campos de alto poder) (figura 2B).
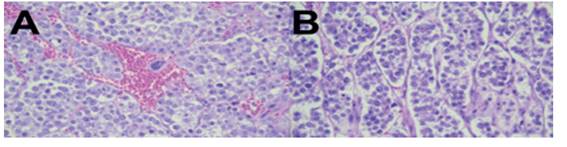
Figura 2 A. Vista microscópica con coloración HyE, 10X: Patrón alveolar separado entre sí por septos de tejido fibroso conectivo. B. 40X: En los septos se observan escasos linfocitos.
Con respecto a los estudios de inmunohistoquímica, las células neoplásicas fueron positivas para SALL4, CD117 y OCT – (figura 3).
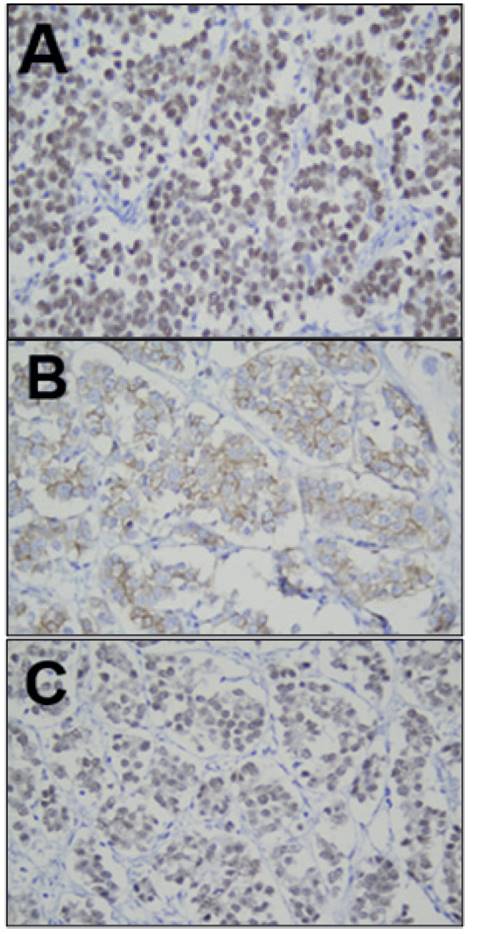
Figura 3 A. Inmunohistoquímica, 40X. SALL4 positivo, patrón nuclear en células tumorales. B. Inmunohistoquímica, 40X. CD 117 positivo, se observa tinción de membrana celular en células tumorales. C. Inmunohistoquímica, 40X. OCT – positivo, patrón nuclear en células tumorales.
Ante la evaluación microscópica característica y la confirmación mediante estudios de inmunohistoquímica, se llegó a la conclusión de que el caso se trataba de DO puro. El estadiaje de la paciente, según la clasificación de la Federación Internacional de Ginecología y Obstetricia (FIGO), fue como estadio IA, y según la clasificación TNM (T: tumor, N: nódulo, M: metástasis) con pT1a (p: patológico, T: tumor). La paciente respondió bien a la anexectomía/ooforectomía unilateral que se le realizó y posteriormente fue referida a consulta externa de ginecología oncológica para control. Un año después de la cirugía permanece sin signos de recurrencia.
DISCUSIÓN
El DO es el subtipo más común de TMCG. Suele presentarse durante edades reproductivas tempranas como en nuestra paciente. Si bien los síntomas son inespecíficos, Rungoutok M. y Suprasert P. comunicaron en su estudio que los tres síntomas más comunes fueron sensación de masa pélvica, dolor abdominal bajo y distensión abdominal 10), tal como ocurrió en el caso presentado.
La TC permite determinar la localización y extensión de la masa. En el caso se evidenció una masa sólida derecha bien definida de carácter neoformativa. Sin embargo, también se podrían hallar multilobulaciones con interposición de tabiques fibrovasculares y un prominente pedículo vascular con vasos tortuosos 11).
Usualmente los DO son diagnosticados con un tamaño mayor a 15 cm 12). En una revisión de 140 casos de DO se halló que el tamaño promedio fue 13 cm de diámetro 11). Se ha publicado el caso de una gestante con un DO catalogado como gigante de 25 x 19 x 24 cm 7). En nuestro caso, la paciente presentaba un tumor de 25 x 20 x 13 cm. Según los antecedentes descritos se le cataloga como un DO gigante.
La inmunohistoquímica en nuestro caso, el SALL4 ayudó a diferenciar TMCG (sall4+) de los tumores de cordones sexuales (sall4-); el OCT – se expresa en células germinativas y se encuentra negativo en el tumor de saco vitelino. El CD117 solo se encuentra positivo en los DO o seminomas en comparación con el resto de TMCG 5). Una revisión de 140 casos hace énfasis en que el disgerminoma tiene hallazgos muy particulares en inmunohistoquímica comparados a sus diagnósticos diferenciales por lo cual es clave para su diagnóstico preciso 11
El DO no suele presentar alteraciones hormonales, pero hasta en un 5% de los casos se puede evidenciar una elevación de la hCG-β y dentro de la serología, elevación de LDH y en menor medida FA. Nuestro caso presentó la elevación de estos valores 11).
En pacientes jóvenes, el tratamiento estándar para estadios IA consiste en una cirugía conservadora de la fertilidad (teniendo en cuenta el deseo de paridad) con anexectomía y biopsia de congelación unilateral más estadiaje, No suele indicarse quimioterapia en esta etapa a menos que exista recurrencia 7). En etapas avanzadas suele realizarse una resección completa más 4 ciclos de quimioterapia (13). En el caso de nuestra paciente, al tratarse de un estadio IA, se realizó una anexectomía / ooforectomia unilateral más biopsia por congelación y estadiaje conservador. Si bien es cierto se tiene un hallazgo incidental de carcinoma in situ, aún no existe evidencia de que guarde relación con el DO.
En conclusión, el DO es un tumor maligno poco común y de etiología desconocida; es frecuente en mujeres jóvenes en edad reproductiva. Los síntomas más comunes son la sensación de masa pélvica, dolor abdominal bajo y distensión abdominal. Es fundamental el estudio inmunohistoquímico y anatomopatológico para confirmar el diagnóstico. El pronóstico es favorable sobre todo en los estadios tempranos, por lo que se debe derivar estos casos oportunamente a un centro especializado y continuar con un manejo individualizado.
REFERENCIAS
1. Gaona-Luviano P, Medina-Gaona LA, Magaña-Pérez K. Epidemiology of ovarian cancer. Chinese Clin Oncol. 2020;9(4):47. doi: 10.21037/cco-20-34 [ Links ]
2. Uccello M, Boussios S, Samartzis EP, Moschetta M. Systemic anti-cancer treatment in malignant ovarian germ cell tumours (MOGCTs): current management and promising approaches. Ann Transl Med. 2020;8(24):1713-1713. doi: 10.21037/atm.2020.04.15 [ Links ]
3. Tîrnovanu MC, Florea ID, Tanase A, Toma BF, Cojocaru E, Ungureanu C, et al. Uncommon metastasis of ovarian dysgerminoma: A case report and review of the literature. Med. 2021;57(6):1-12.doi.org/10.3390/medicina57060534 [ Links ]
4. Cheung A, Shah S, Parker J, Soor P, Limbu A, Sheriff M, et al. Non-Epithelial Ovarian Cancers: How Much Do We Really Know? Int J Environ Res Public Health. 2022;19(3): 1106. doi: 10.3390/ijerph19031106 [ Links ]
5. Song S. Dysgerminoma PathologyOutlines.com website [Internet]. Michigan [cited 2023 May 6]. Available from: https://www.pathologyoutlines.com/topic/ovarytumordysgerminoma.html . [ Links ]
6. Cacioppa LM, Crusco F, Marchetti F, Duranti M, Renzulli M, Golfieri R. Magnetic resonance imaging of pure ovarian dysgerminoma: a series of eight cases. Cancer Imaging. 2021;21(1):1-7. doi: 10.1186/s40644-021-00427-1 [ Links ]
7. Zhang XW, Zhai LR, Huang DW, Jiang ZD, Yu T, Liu SY, et al. Pregnancy with giant ovarian dysgerminoma: A case report and literature review. Medicine (Baltimore). 2020;99(41):1-7. doi: 10.1097/MD.0000000000021214 [ Links ]
8. Hara N, Suwanai H, Abe H, Yakou F, Ishikawa T, Urayama M, et al. Hypercalcemia associated with dysgerminoma and elevation of calcitriol: A case report and review of the literature. SAGE Open Med Case Reports. 2022;10:1-6. doi: 10.1177/2050313X211068562 [ Links ]
9. Adhikari S, Joti S, Chhetri PK. Paediatric Ovarian Dysgerminoma: A Case Report. J Nepal Med Assoc. 2022;60(255):985-988. doi: 10.31729/jnma.7894 [ Links ]
10. Rungoutok M, Suprasert P. Oncology and reproductive outcomes over 16 years of malignant ovarian germ cell tumors treated by fertility sparing surgery. World J Clin Oncol 2022; 13(10): 802-812. doi: 10.5306/wjco.v13.i10.802 [ Links ]
11. Warnnissorn M, Watkins JC, Young RH. Dysgerminoma of the ovary: An analysis of 140 cases emphasizing unusual microscopic findings and resultant diagnostic problems. Am J Surg Pathol . 2021;45(8):1009-1027. doi:0000000000001687 [ Links ]
12. Rogers D, Menias C, Shaaban A. Malignant Germ Cell Tumors of the Ovary: Clinical and Imaging Features. Radiol Clin North Am. 2023 Jul;61(4):579-594. doi: 10.1016/j.rcl.2023.02.004. doi: 10.1016/j.rcl.2023.02.004 [ Links ]
13. Sas I, Serban DM, Tomescu LC, Nicolae N. Ovarian dysgerminoma in pregnancy: A case report. Medicine (Baltimore). 2021;100(14):e25364. doi: 10.1097/MD.0000000000025364 [ Links ]
Comments (0)