Le risque de fracture augmente avec l’âge, en raison du déclin de la robustesse squelettique et de l’augmentation du risque de chute. Au Canada, plus de 2 millions de personnes vivent avec l’ostéoporose1. Au pays, chaque année, environ 150 personnes pour 100 000 subissent une fracture de la hanche, l’un des types de blessure considérés comme les plus graves en lien avec l’ostéoporose. Les fractures sont liées à une morbidité accrue, à une surmortalité, à une dégradation de la qualité de vie et à une perte d’autonomie2. Bien qu’on pense souvent que l’ostéoporose touche surtout les femmes âgées, sa fréquence chez les hommes est largement sous-évaluée, et l’affection n’est pas traitée suffisamment, malgré des issues comparativement plus défavorables en cas de fracture3, ce qui souligne l’importance de publier des lignes directrices pour les hommes.
L’ostéoporose, qu’on définit comme une baisse de la densité minérale osseuse (DMO) d’au moins 2,5 écarts-types par rapport au pic de la masse osseuse (score T ≤ −2,5), est un indicateur de risque de fracture accru; ce risque est influencé par l’âge, le sexe et d’autres facteurs4. On peut émettre un diagnostic clinique d’ostéoporose chez les personnes de 50 ans et plus si elles ont subi après 40 ans une fracture de la hanche, de la colonne vertébrale, de l’humérus ou du bassin consécutive à un traumatisme léger, ou qui ont un risque absolu de fracture de 20 % ou plus sur les 10 prochaines années, établi au moyen d’un outil d’évaluation du risque de fracture (FRAX ou outil de l’Association canadienne des radiologistes et d’Ostéoporose Canada [CAROC])5–7.
Les récentes avancées en matière d’évaluation du risque de fracture et de prise en charge, pharmacologique ou non, exigent une actualisation des lignes directrices de pratique clinique de 2010 d’Ostéoporose Canada pour le diagnostic et la prise en charge de l’ostéoporose au Canada8.
Champ d’applicationÉlaborées par le groupe d’actualisation des lignes directrices 2023 d’Ostéoporose Canada, ces lignes directrices actualisées visent à aider les professionnelles et professionnels de la santé en soins primaires au Canada dans le repérage des femmes ménopausées et des hommes de 50 ans et plus vivant dans la collectivité pour la présence de facteurs de risque d’ostéoporose et de fracture ainsi que dans la prestation des interventions visant à optimiser la santé osseuse et à prévenir les fractures. Tout le long du document, nous utiliserons les termes femmes et hommes pour désigner le sexe biologique des personnes.
Les recommandations concernant le traitement qui figurent ici se concentrent sur les personnes atteintes d’ostéoporose primaire. Nous ne toucherons pas aux cas complexes de la patientèle atteinte de cancer, de maladies graves ou de maladies évolutives pouvant entraîner une perte osseuse (p. ex., hyperparathyroïdie, myélome multiple, nouveau diagnostic de polyarthrite rhumatoïde, autres maladies inflammatoires nécessitant l’administration de fortes doses de glucocorticoïdes). Les maladies connues pour causer de l’ostéoporose secondaire devraient être envisagées, et les personnes atteintes devraient être dirigées vers des spécialistes possédant l’expertise appropriée en vue d’une éventuelle prise en charge concertée (annexe 1, tableau supplémentaire 5, accessible en anglais au www.cmaj.ca/lookup/doi/10.1503/cmaj.221647/tab-related-content).
Les chutes sont la principale cause de fracture chez les personnes âgées adultes au Canada9. Parce que les recommandations détaillées en matière de prévention des chutes dépassent le champ d’application des présentes lignes directrices, nous invitons les lectrices et lecteurs à s’adresser au Groupe d’étude canadien sur les soins de santé préventifs pour obtenir des informations sur la prévention des chutes10. De plus, des recommandations propres à la prévention des fractures chez les personnes admises en soins de longue durée ont déjà été publiées11.
RecommandationsNous avons formulé 25 recommandations et 10 énoncés de bonne pratique en adoptant l’approche GRADE (Grading of Recommendations, Assessment, Development and Evaluation) (tableau 1). Ces recommandations sont divisées en sections : activité physique, alimentation, évaluation du risque de fracture, instauration du traitement, interventions pharmacologiques, durée et séquence du traitement, et monitorage12,13.
Tableau 1:Interprétation de la force des recommandations selon l’approche GRADE12,13
La figure 1 présente l’approche intégrée en matière de promotion de la santé osseuse et de prévention des fractures chez les femmes ménopausées et les hommes âgés de 50 ans et plus, alors que la figure 2 présente une approche de pharmacothérapie, lorsque c’est nécessaire. L’annexe 2 (accessible en anglais au www.cmaj.ca/lookup/doi/10.1503/cmaj.221647/tab-related-content) fournit des tableaux de données probantes à l’appui des décisions (p. 50 et suivantes) justifiant l’attribution de la force des recommandations et le degré de certitude des données.
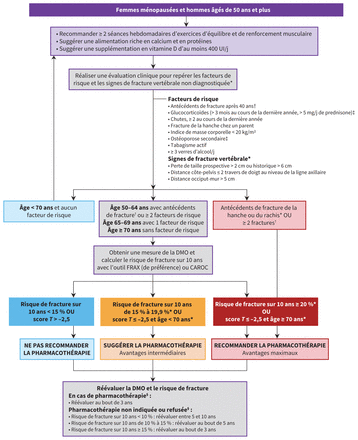
 Figure 1:
Figure 1: Approche intégrée de la prise en charge de la santé osseuse et de la prévention des fractures chez les femmes ménopausées et les hommes âgés de 50 ans et plus. Les tableaux supplémentaires 1 à 6 de l’annexe 1 (accessible en anglais au www.cmaj.ca/lookup/doi/10.1503/cmaj.221647/tab-related-content) contiennent des informations complémentaires sur l’activité physique et l’alimentation, les causes secondaires d’ostéoporose et l’évaluation des fractures vertébrales. Remarque : DMO = densité minérale osseuse. *Envisager une imagerie de profil de la colonne vertébrale pour dépister les fractures vertébrales. La découverte de fractures vertébrales non diagnostiquées peut guider le choix et la durée du traitement (annexe 1, tableau supplémentaire 6). †Fractures survenant après 40 ans attribuable à un coup léger. Les fractures des mains, des pieds et des os craniofaciaux ne sont pas considérées comme ostéoporotiques. ‡Maladies connues pour entraîner de l’ostéoporose secondaire (annexe 1, tableau supplémentaire 5); envisager une demande de consultation en spécialité pour une prise en charge concertée. §Réévaluer plus tôt en cas d’apparition de causes secondaires (annexe 1, tableau supplémentaire 5), de nouvelles fractures ou d’autres facteurs de risque de perte osseuse rapide.
Dans le processus de décision, nous avons tenu compte du degré de certitude des données ainsi que de l’effet des avantages et des risques des interventions sur les résultats cliniques. Les hommes sont faiblement représentés dans les données cliniques en ce qui concerne certains résultats et certaines interventions; lorsque cela était pertinent, nous avons donc modulé la force des recommandations selon le sexe en fonction du degré de certitude des données. L’ensemble des recommandations et des énoncés de bonne pratique se fonde sur la contribution des médecins de premier recours et des patientes et patients partenaires et tient compte de leurs valeurs et préférences. Bien que nous n’ayons pas réalisé d’analyses coût–efficacité, nous avons tout de même inclus, lorsqu’elles étaient disponibles, certaines informations sur les rapports coût–efficacité dans l’élaboration des recommandations ainsi que les sources pertinentes dans les tableaux de données probantes à l’appui des décisions appropriés14–16.
Chez les adultes de plus de 40 ans, l’ostéoporose peut mener à des fractures. Souvent appelées fractures de fragilisation ou fractures ostéoporotiques, elles surviennent à la suite d’une chute depuis la position debout ou lorsqu’une force appliquée sur l’os est jugée insuffisante pour fracturer un os normal17. Sont classées comme des fractures ostéoporotiques graves majeures les fractures de de la hanche, de vertèbres, de l’humérus et de l’avantbras distal. À l’inverse, sont considérées comme des fractures non ostéoporotiques les fractures de la main, du pied et des os craniofaciaux1. Les fractures vertébrales, symptomatiques ou non, sont associées à un risque accru de fractures à tous les sites osseux et peuvent être détectées ou confirmées par des radiographies18,19.
Activité physiqueLes recommandations en matière d’activité physique dans une optique de prévention des chutes et des fractures chez les femmes ménopausées et les hommes de 50 ans et plus se trouvent au tableau 2 (voir aussi l’annexe 1, tableau supplémentaire 1, pour connaître les définitions et les principaux points à retenir sur l’activité physique). Les tableaux de données probantes à l’appui des décisions se trouvent à l’annexe 2 (p. 50).
Tableau 2:Recommandations en matière d’activité physique et d’alimentation pour la prévention des chutes et des fractures chez les femmes ménopausées et les hommes âgés de 50 ans et plus*
Des données probantes de grande qualité provenant d’une revue systématique de Cochrane démontrent que l’entraînement de la fonction motrice et de l’équilibre chez les adultes âgés de 50 ans ou plus peut réduire le nombre de chutes (ratio des taux 0,76; intervalle de confiance [IC] de 95 % 0,70–0,80; 41 études, 7290 personnes; données probantes de forte certitude) ainsi que le nombre de personnes qui font des chutes (ratio des taux 0,87; IC de 95 % 0,82–0,91; 38 études, 8288 personnes; données probantes de forte certitude). Selon certaines données, l’entraînement de la fonction motrice et de l’équilibre pourrait réduire le nombre de fractures consécutives à une chute (ratio des taux 0,44; IC de 95 % 0,25–0,76; 7 études, 2139 personnes; données de faible certitude), et pourrait améliorer la qualité de vie (différence moyenne 2,48 points, IC de 95 % 1,31–3,64; 8 études, 854 personnes; données de faible certitude) et la capacité physique fonctionnelle20.
Une revue systématique d’essais cliniques randomisés (ECR) semble indiquer que l’entraînement contre résistance pourrait améliorer la qualité de vie (différence moyenne standardisée 0,75; IC de 95 % 0,54–0,95; 8 études, 421 personnes; données de moyenne certitude), la capacité physique fonctionnelle et la densité minérale osseuse (DMO), en plus de réduire la mortalité21. Associé à l’entraînement de la fonction motrice et de l’équilibre chez les adultes âgés, l’entraînement contre résistance peut contribuer à réduire le nombre de chutes et le nombre de personnes qui font des chutes.
Les données d’une revue systématique d’ECR démontrent que, chez les personnes atteintes d’hypercyphose, les exercices qui ciblent les muscles abdominaux et extenseurs du dos et ceux des épaules pourraient mener à une légère amélioration de la courbure rachidienne, de la qualité de vie, de la capacité physique fonctionnelle et de la force des extenseurs du dos22; toutefois, dans le cas de cyphose structurale (p. ex., résultant d’une fracture vertébrale), ces exercices pourraient n’avoir aucun effet sur la courbure rachidienne.
Des études d’observation donnent à penser que la marche peut réduire la mortalité chez les adultes âgés23, mais ses effets sur les fractures, les chutes, la qualité de vie, la capacité physique fonctionnelle ou les blessures sur les personnes ayant un risque de fracture sont inconnus ou incertains24. Une revue systématique laisse entendre que les exercices d’impact pourraient améliorer la DMO et la capacité physique fonctionnelle, et réduire la mortalité25, mais les bienfaits de ce type d’exercices seul sont incertains, parce qu’ils sont souvent associés à un entraînement contre résistance ou à d’autres activités.
Nous avons mené une revue systématique sur les effets du yoga et des exercices Pilates sur des résultats liés à la santé, et avons découvert que ce type d’activité physique pouvait améliorer la capacité physique fonctionnelle et la qualité de vie chez les adultes âgés, mais leurs effets sur la DMO, les chutes et les fractures sont incertains, et les données probantes chez les personnes ayant un risque de fracture sont peu nombreuses.
Les hommes étaient sous-représentés dans les ensembles de données pour certains des résultats des exercices. Nous avons choisi de ne pas diminuer la force des données probantes pour cause de caractère indirect dans leur application aux hommes parce qu’il n’y avait pas de raison de s’attendre à ce que la direction ou l’ampleur des effets sur les chutes, les fractures, la capacité physique fonctionnelle, la qualité de vie ou les événements indésirables soient différentes dans cette population.
AlimentationLe tableau 2 présente une synthèse des recommandations en matière d’alimentation pour les femmes ménopausées et les hommes âgés de 50 ans et plus qui visent à prévenir les chutes et les fractures (annexe 1, tableau supplémentaire 2 : principaux points à retenir sur l’alimentation). Les tableaux de données probantes à l’appui des décisions se trouvent à l’annexe 2 (p. 114).
Chez les personnes qui suivent un régime alimentaire équilibré (https://guide-alimentaire.canada.ca/fr/guide-alimentaire-en-bref/) et qui ne prennent pas de médicaments contre l’ostéoporose, des suppléments de calcium, de vitamine D et de protéines sont susceptibles de n’avoir que peu ou pas d’effets, bons ou mauvais, sur les fractures (annexe 1, tableau supplémentaire 2). Dans des revues systématiques et des études récentes, menées sur la supplémentation en calcium et en vitamine D, principalement chez des personnes ne prenant pas de médicaments contre l’ostéoporose et sans carence nutritionnelle connue, les suppléments étaient associés à de maigres bienfaits au regard de la réduction des fractures, quel qu’en soit l’emplacement26,27. On a observé des diminutions minimales des chutes lorsqu’il y avait prise de suppléments de vitamine D, seuls ou en association avec du calcium27,28. Les données probantes sur l’effet des suppléments de magnésium et de vitamine K sur la santé osseuse sont peu nombreuses (annexe 2, p. 161).
La réduction du taux de fracture de la hanche par la prise de suppléments de protéines pourrait être minime29,30. Les données probantes sont incertaines, car les études portaient sur l’évaluation de l’apport de protéines associé au régime alimentaire et non à la prise de suppléments, souvent égaux ou supérieurs aux recommandations (0,8–1,3 g de protéines/kg de poids corporel/j) chez des personnes ayant une bonne alimentation. On ne sait pas si la source de protéines a un effet sur la santé osseuse, car la plupart des sujets consommaient peu de protéines d’origine végétale. Les effets d’un régime riche en protéines sur les résultats fonctionnels étaient minimes31.
Évaluation du risque de fractureLe tableau 3 présente les recommandations en matière d’évaluation du risque de fracture; les tableaux de données probantes à l’appui des décisions correspondants sont à l’annexe 2 (p. 182). La figure 1 montre l’application clinique de ces recommandations.
Tableau 3:Évaluation du risque de fracture et instauration du traitement chez les femmes ménopausées et les hommes âgés de 50 ans et plus*
Nous suggérons une approche d’évaluation fondée sur l’âge et la présence de facteurs de risque cliniques (une approche dite ciblée) dans le but de repérer les personnes qui devraient se soumettre à une mesure de la DMO (données de faible certitude chez les femmes ménopausées de 50–64 ans; données de moyenne certitude chez les femmes âgées de 65 ans ou plus32–34; données de très faible certitude chez les hommes14,32,35). Chez la plupart des gens, cette stratégie permet un report du début de la mesure de la DMO à l’âge de 70 ans et une catégorisation appropriée des personnes ayant un haut risque de fracture établi à l’aide d’outils d’évaluation du risque de fracture disponibles au Canada32. Les patientes et patients partenaires ont exprimé un fort besoin d’orientation pour le juste repérage tant des femmes que des hommes en vue d’une mesure appropriée de la DMO établie en fonction de la présence de facteurs de risque cliniques.
Au Canada, le FRAX et le CAROC sont 2 des principaux outils d’évaluation du risque sur 10 ans de fracture ostéoporotique majeure, validés. L’outil FRAX est aussi efficace, voire légèrement plus, que les autres outils36, et mène à une meilleure classification du risque de fracture que le CAROC (amélioration nette de la reclassification : catégorie de risque, 2 %; recommandation relative au traitement, 1 %)37. Nous suggérons d’utiliser de préférence l’outil canadien FRAX pour l’estimation du risque de fracture; cependant, cette recommandation est conditionnelle, en raison de la certitude modérée des données probantes et de leur caractère indirect chez les hommes37.
Instauration du traitementLe tableau 3 liste les recommandations en matière d’instauration de traitement; les tableaux de données probantes à l’appui des décisions correspondants sont à l’annexe 2 (p. 190 et 314).
Il n’existe pas de consensus sur ce que serait l’approche optimale visant à déterminer un seuil de traitement38. En établissant des seuils de mise en route de pharmacothérapie, nous avons considéré le fardeau des fractures dans la population canadienne, les liens entre les issues des fractures et le risque initial de fracture, l’efficacité du traitement pharmacologique, l’importance du repérage des personnes présentant un haut risque de fracture pour prévenir la plupart de ces lésions et l’importance de limiter le surtraitement chez les personnes ayant un faible risque, du point de vue de la population et de la patientèle38.
Des antécédents de fracture vertébrale (diagnostiquée ou constatée par imagerie) ou de la hanche et la survenue de plus d’une fracture sont des indicateurs de risque élevé de fracture8. Des essais cliniques randomisés fournissent des données probantes de certitude modérée ou élevée qui démontrent d’importants bienfaits en matière de réduction des fractures associés au traitement pharmacologique chez les personnes souffrant d’ostéoporose (score T ≤ −2,5 ou antécédents de fracture) ainsi qu’une réduction d’environ 50 % du risque de fracture vertébrale, de 30 % du risque de fracture de la hanche et de 20 % du risque de fracture non vertébrale après 3 ans de traitement39–41. En outre, compte tenu des données d’observation provenant d’un vaste registre clinique, nous avons aussi établi comme recommandation conditionnelle un seuil d’intervention de 20 % pour un risque sur 10 ans de fracture majeure (mesuré à l’aide de l’outil FRAX ou CAROC), car cette stratégie a fait ses preuves en ce qui a trait au nombre de fractures prévenues chez les femmes âgées de 50 ans et plus et au nombre de femmes traitées (pour limiter le surtraitement)38. Nous n’avons pas diminué le degré de certitude des données probantes chez les hommes; en effet, ces données semblent indiquer qu’il n’y a pas de différence dans les avantages et les risques liés au traitement en fonction du sexe39,41–44.
Les services de liaison pour fractures (https://fls.osteoporosis.ca/fr/), qui fournissent actuellement dans quelques régions canadiennes des services d’exploration et de mise en route des traitements après une fracture, favorisent une utilisation appropriée de l’évaluation du risque de fracture et des traitements contre les fractures, en plus d’offrir un bon rapport coût–efficacité45. Nous recommandons que les femmes ménopausées et les hommes âgés de 50 ans et plus ayant subi récemment une fracture aient accès à un service de liaison pour fractures pour améliorer le dépistage de l’ostéoporose et l’instauration d’un traitement contre la maladie.
Interventions pharmacologiquesLe tableau 4 présente les recommandations en matière de pharmacothérapie chez les personnes qui commencent un traitement (renseignements supplémentaires au tableau 5); un algorithme d’application clinique est présenté à la figure 2. Les tableaux de données probantes à l’appui des décisions se trouvent à l’annexe 2 (p. 323).
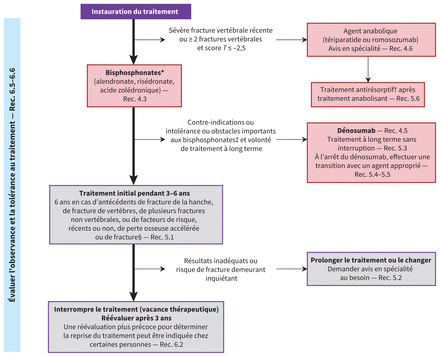
 Figure 2:
Figure 2: Approche pharmacothérapeutique de prévention des fractures. Remarque : Rec. = recommandation (recommandations complètes aux tableaux 4, 6 et 7). *L’hormonothérapie ménopausique est suggérée en solution de rechange chez les femmes de moins de 60 ans ou ménopausées depuis 10 ans ou moins dont la priorité est de soulager des symptômes importants de la ménopause (Rec. 4.4). †Les traitements antirésorptifs comprennent les bisphosphonates (alendronate, risédronate et acide zolédronique), le dénosumab, le raloxifène et l’hormonothérapie ménopausique. ‡Le raloxifène est préféré à l’absence de traitement chez les femmes ayant des contre-indications ou une intolérance importante à d’autres traitements suggérés, ou les refusant (Rec. 4.7). §La liste des facteurs de risque est présentée à la figure 1 et les causes d’ostéoporose secondaires figurent au tableau supplémentaire 5 de l’annexe 1.
Tableau 4:Interventions pharmacologiques chez les femmes ménopausées et les hommes âgés de 50 ans et plus chez qui un traitement antiostéoporotique est recommandé ou suggéré*
Tableau 5:Médicaments pour traiter l’ostéoporose*
Les traitements pharmacologiques se composent de médicaments antirésorptifs, qui inhibent l’activité ostéoclastique, et de médicaments anabolisants, qui stimulent la formation de nouvelle masse osseuse. Parmi les médicaments antirésorptifs, on trouve les bisphosphonates (alendronate, risédronate, acide zolédronique), le dénosumab, le raloxifène et l’hormonothérapie ménopausique; parmi les médicaments anabolisants, citons le tériparatide et le romosozumab (tableau 5).
Les données probantes sur les effets des médicaments étaient de certitude modérée ou élevée39. Bien que la plupart des études aient été menées chez des femmes ménopausées, les données concernant les hommes atteints d’ostéoporose primaire ou d’ostéoporose consécutive à l’hypogonadisme démontrent des effets sur les fractures semblables à ceux observés chez les femmes qui prennent des bisphosphonates et du dénosumab; aussi avons-nous appliqué aux hommes les résultats découlant des données probantes recueillies chez les femmes, et nous avons indiqué une certitude modérée en raison du caractère quelque peu indirect des données39,41,42.
De manière générale, la prise de bisphosphonates pendant 3 ans permet une réduction de 20–30 fractures vertébrales, de 10 fractures non vertébrales et de 3 fractures de la hanche pour 1000 personnes, comparativement à l’absence de traitement39,41. Par rapport au placébo, il ne semble y avoir que très peu d’effets indésirables à court terme (≤ 3 ans) de la prise orale de bisphosphonates, qui peut entraîner des troubles digestifs comme l’œsophagite et des ulcères (différence de < 1 %), et de la perfusion d’acide zolédronique, qui peut entraîner des symptômes pseudogrippaux passagers; par ailleurs, des données très incertaines indiqueraient un risque accru de fibrillation auriculaire43. Les avantages du dénosumab sont semblables à ceux de l’acide zolédronique39, mais le médicament produirait davantage d’effets indésirables : augmentation de 7 % du risque d’événement grave (p. ex., infections menant à l’hospitalisation) par rapport au placébo47, et augmentation du risque de 14 % et de 7 % par rapport à l’alendronate et à l’acide zolédronique, respectivement15. L’administration différée des doses ou l’arrêt du dénosumab sont associés à une perte osseuse rapide et pourraient mener à des fractures vertébrales52.
Chez les femmes ayant un risque élevé de fracture (p. ex., fracture vertébrale grave récente, ou plus d’une fracture vertébrale et un score T ≤ −2,5)53, des données probantes de certitude élevée indiquent que les médicaments anabolisants (tériparatide ou romosozumab) peuvent davantage réduire les fractures vertébrales et non vertébrales et les fractures de la hanche que les bisphosphonates (réduction de 35, 18 et 5 événements pour 1000 personnes, respectivement)39,43. Chez les hommes, on ne dispose que de données indirectes, qui sont par conséquent de certitude modérée. L’arrêt d’un traitement anabolisant sans prise subséquente d’un médicament antirésorptif augmente le risque de perte des gains de la densité osseuse54,55. Chez la plupart des gens, les inconvénients associés au tériparatide, au romosozumab ou au dénosumab (comme la fréquence d’injection, les risques associés à l’arrêt du traitement, la nécessité d’un médicament de transition à l’arrêt du traitement et les coûts) sont probablement plus importants que les avantages, comparativement aux bisphosphonates56. Toutefois, chez les personnes ayant un risque élevé de fractures, les avantages pourraient l’emporter.
Durée et séquence du traitementLe tableau 6 liste les recommandations en matière de durée et de séquence de traitement. Les tableaux de données probantes à l’appui des décisions se trouvent à l’annexe 2 (p. 330).
Tableau 6:Durée et séquence du traitement chez les femmes ménopausées et les hommes âgés de 50 ans et plus recevant un traitement antiostéoporotique*
La prise orale de bisphosphonates pendant 5 ans ou plus (p. ex., 10 ans dans l’étude de prolongation sur l’alendronate57), comparativement à des périodes d’utilisation plus courtes, ne se traduit probablement pas par une diminution du nombre de fractures de la hanche ou le nombre total de fractures, mais permet une réduction faible ou modérée du nombre de fractures vertébrales diagnostiquées cliniquement (22 de moins pour 1000) et observées à la radiographie (17 de moins pour 1000)43,58. La prise annuelle d’acide zolédronique pendant 6 ans, comparativement à la prise annuelle pendant 3 ans, ne se traduit probablement pas par une diminution du nombre de fractures de la hanche et de fractures non vertébrales, mais pourrait réduire considérablement le nombre de fractures vertébrales confirmées à la radiographie, bien que les données probantes soient incertaines (56 de moins pour 1000, de 88 à 5 de moins)48.
Dans le cas des bisphosphonates, les effets indésirables pourraient s’accentuer avec le temps : après 6 ans, on dénombrait de 39–131 fractures fémorales atypiques (fracture de stress ou d’insuffisance se produisant sur le corps du fémur) pour 100 000 personnes-années, comparativement à 25 pour la prise du médicament pendant 3–5 ans, et on notait un risque plus élevé chez les femmes se considérant comme asiatiques49; le risque d’ostéonécrose de la mâchoire (problème de santé qui entraîne la nécrose d’au moins une portion de l’os de la mâchoire, qui devient exposée dans la cavité orale) est de 25 pour 100000 personnesannées, et passe environ au double lorsque l’utilisation du médicament dépasse 5 ans50. Après 6 ans d’utilisation, les inconvénients du traitement continu sont donc susceptibles de dépasser les avantages, sauf chez les personnes qui ont un risque élevé de fracture (p. ex., antécédents de fracture de la hanche ou de fracture vertébrale, fracture récente, fractures multiples).
Les données probantes semblent indiquer que les avantages du dénosumab ne diminuent pas après 10 ans d’utilisation, et que l’incidence des fractures fémorales atypiques et d’ostéonécrose de la mâchoire est relativement stable à 8 et 52 pour 100 000 personnes-années, respectivement51. On manque de données comparatives sur les effets d’un médicament pris de façon continue ou en alternance en cas de réaction inadéquate au traitement aux bisphosphonates (p. ex., diminution importante de la DMO59–62).
MonitorageLe tableau 7 présente les recommandations en matière de monitorage chez la patientèle qui commence un traitement pharmacologique ou qui cesse la prise de bisphosphonates. Les tableaux de données probantes à l’appui des décisions se trouvent à l’annexe 2 (p. 249).
Tableau 7:Monitorage du traitement antiostéoporotique chez les femmes ménopausées et les hommes âgés de 50 ans et plus *
Des données probantes directes de très faible degré de certitude et des données probantes indirectes de degré de certitude élevée chez les femmes et les hommes indiquent une possible diminution du risque de fracture chez les personnes qui s’étaient soumises à une mesure de la DMO environ 3 ans après le début d’un traitement63,64. Les marqueurs de renouvellement des cellules osseuses permettent de mesurer le processus de remodelage osseux (p. ex., télopeptide C-terminal du collagène de type I pour mesurer la résorption osseuse, phosphatase alcaline osseuse pour mesurer la formation osseuse)65. Des données existantes, mais inadéquates, indiquent que l’utilisation clinique des marqueurs de renouvellement des cellules osseuses pourrait être efficace pour réduire le risque de fracture ou pour prédire les fractures chez les personnes qui sont en arrêt de traitement par les bisphosphonates66.
MéthodesLe présent guide a été élaboré par les bénévoles du groupe d’actualisation des lignes directrices 2023 d’Ostéoporose Canada dans le but de répertorier les avancées en matière d’évaluation du risque de fracture et de prise en charge non pharmacologique et pharmacologique de l’ostéoporose depuis la publication des lignes directrices de 2010 par Ostéoporose Canada8. Nous avons utilisé l’approche GRADE13 et appliqué un processus d’assurance de la qualité conforme aux normes de qualité et de présentation des rapports de la grille AGREE II (Appraisal of Guidelines for Research & Evaluation)67. Les travaux ont commencé en juin 2017 et se sont terminés en novembre 2022.
Composition du comité de rédaction des lignes directricesLe groupe d’actualisation des lignes directrices 2023 d’Ostéoporose Canada était constitué d’un comité directeur (composé de S.N.M., S.K., N.S., S.F., L.G., W.W., H.M.-B. [membre d’office] et L.F.) formé par le conseil consultatif scientifique d’Ostéoporose Canada, d’un comité de surveillance des conflits d’intérêts (H.M.-B., L.F. et R.R.), de 4 groupes de travail (présidence : activité physique [L.G.]; alimentation [W.W.]; évaluation du risque de fracture [S.F.]; pharmacothérapie [S.K. et N.S.]) et d’un comité d’application des connaissances. Des médecins de premier recours et 5 patientes et patients partenaires étaient représentés au comité directeur et faisaient partie des groupes de travail, afin de garantir la pertinence des informations pour les utilisateurs et utilisatrices cibles. Une méthodologiste (N.S.) possédant une expertise en matière d’élaboration de lignes directrices et de l’approche GRADE faisait aussi partie du comité directeur et du groupe de travail sur la pharmacothérapie, et a travaillé en consultation avec les autres groupes de travail.
Le comité directeur était responsable de l’organisation des processus, de l’établissement des priorités, du recrutement des membres des groupes de travail, de la surveillance des activités de ces groupes et de la préparation du matériel en vue de la publication. Nous avons appliqué les principes d’équité, de diversité et d’inclusion dans le processus de recrutement des membres des groupes de travail, et avons assuré une juste représentation selon le sexe, l’âge, l’expertise (p. ex., médecins, pharmaciennes et pharmaciens, physiothérapeutes, nutritionnistes, patientes et patients partenaires) et l’emplacement au Canada. Les présidentes et présidents des groupes de travail avaient pour tâche de recruter les membres de leur groupe, avec l’appui du comité directeur. Nous avons recruté les patientes et patients partenaires de façon à assurer une représentativité géographique par l’intermédiaire du Réseau canadien des personnes atteintes d’ostéoporose (RCPO), le volet d’Ostéoporose Canada pour les patients, qui couvre tout le pays (https://osteoporosecanada.ca/le-rcpo-le-volet-dosteoporose-canada-dedie-aux-patients/).
Sélection des thèmes prioritairesNous avons établi les grandes priorités et sélectionné toutes les questions de recherche au moyen de sondages réalisés chez plus de 1000 patientes et patients partenaires68 et médecins de premier recours, et à l’aide de témoignages directs de personnes ayant une expérience vécue de l’ostéoporose, de médecins de premier recours et de spécialistes de la santé osseuses, recueillis à la première rencontre en personne (2 juin 2017; 35 personnes). Chaque groupe de travail a formulé des questions au moyen du modèle PICO (population, intervention, comparaison et résultat [outcome]), questions révisées par le comité directeur (annexe 2, Questions, p. 22).
Les paramètres d’intérêt étaient les fractures de la hanche, les fractures vertébrales, toutes les fractures, la mortalité liée aux fractures, la capacité physique fonctionnelle et les incapacités, la qualité de vie et le bien-être et les risques comme les événements indésirables associés aux médicaments, notamment les fractures fémorales atypiques et l’ostéonécrose de la mâchoire68. Le groupe de travail sur l’activité physique a aussi tenu compte des chutes. Nous avons convenu par consensus de la variation du risque absolu qui serait considérée comme cliniquement importante par la patientèle et les professionnelles et professionnels de la santé, selon les résultats (annexe 2, Paramètres d’intérêt, p. 20).
Recherche documentaire et évaluation de la qualitéNous avons mené des recherches documentaires (annexe 2, Stratégies de recherche, p. 27), d’abord pour trouver des revues systématiques d’ECR récentes. En l’absence de nouvelles données, nous avons effectué nous-mêmes une revue systématique de la littérature primaire (d’abord des ECR, puis, à défaut de documents, des études observationnelles)21,22,24,25,69,70. Chaque groupe de travail avait l’appui stratégique d’une ou d’un bibliothécaire de recherche. L’élaboration de certaines des recommandations s’est appuyée sur les résultats d’analyse d’un vaste registre observationnel de cohortes canadiennes (Manitoba Bone Mineral Density)32,38. Nous avons recherché des revues systématiques sur les valeurs et les préférences de la patientèle. Enfin, lorsque des données probantes n’étaient pas disponibles ou qu’elles étaient de très faible qualité, nous avons tenu compte des données indirectes.
Les recherches systématiques les plus récentes remontaient à octobre 2020; chaque groupe de travail a sondé les publications existantes pour y trouver des ECR pertinents jusqu’à l’automne 2022 (ou la publication des revues systématiques, pour le groupe de travail sur l’activité physique). Nous avons vérifié si des articles avaient été retirés des résultats des recherches (annexe 2, Groupe de travail sur la pharmacothérapie, p. 49). Chaque groupe de travail a fait une synthèse des données probantes, a déterminé s’il y avait ou non présence de biais et a élaboré des tableaux de données probantes à l’appui des décisions (annexe 2, Tableaux de données probantes à l’appui des décisions, p. 50).
Élaboration des recommandationsAprès l’élaboration des tableaux de données probantes à l’appui des décisions, chaque groupe de travail a formulé les recommandations à l’aide de l’approche GRADE13. Chaque groupe de travail a fondé ses décisions sur les avantages et les risques, les valeurs et préférences de la patientèle, les ressources, l’équité, l’acceptabilité et la faisabilité, et a présenté ses premiers travaux à une rencontre en personne (15 novembre 2019; 28 personnes). Les premières décisions sur les recommandations se sont prises séparément, dans chaque groupe de travail, par vote (par courriel ou avec le logiciel GRADEpro [https://gradepro.org]) ou par consensus, selon la taille et la composition des groupes.
La force de chaque recommandation a été classée selon le système GRADE, soit forte (« Nous recommandons… ») ou conditionnelle (« Nous suggérons… ») (tableau 1). Certaines recommandations répondaient aux critères du groupe de travail GRADE en ce qui concerne les énoncés de bonne pratique, et le groupe des lignes directrices a convenu que les retombées de la mise en œuvre des énoncés de bonne pratique seraient largement favorables (malgré l’existence de données probantes indirectes à l’appui) et qu’il n’était plus nécessaire de procéder à d’autres collectes et synthèses de données12. Les recommandations et les énoncés de bonne pratique de chaque groupe de travail ont été révisés et approuvés par le comité directeur, puis par l’ensemble du groupe d’actualisation des lignes directrices 2023 d’Ostéoporose Canada.
Examen externeLes parties prenantes concernées (annexe 2, Parties prenantes, p. 18), déterminées par le comité directeur, ont fourni une rétroaction en octobre 2022 sur la question de la clarté et de l’utilité clinique des recommandations. Chaque groupe de travail a examiné la rétroaction sur les recommandations qu’il avait élaborées; le comité directeur a ensuite passé en revue les changements proposés et les a intégrés aux lignes directrices le cas échéant, qui ont ensuite été examinées et approuvées par le groupe d’actualisation des lignes directrices 2023 d’Ostéoporose Canada.
Gestion des intérêts concurrentsLe processus de gestion des intérêts concurrents a été entamé avant l’élaboration des lignes directrices et s’est poursuivi sur toute sa durée, conformément aux principes du Réseau international en matière de lignes directrices et sous le contrôle du comité de surveillance des conflits d’intérêts (annexe 2, Conflits d’intérêts, p. 6)71. Les présidentes et présidents ainsi qu’au moins la moitié des membres des groupes de travail ont dû démontrer qu’ils étaient libres de tout intérêt financier concurrent pendant le processus d’élaboration des lignes directrices. Les membres ayant des intérêts financiers concurrents ont été exclus des étapes de formulation et de vote des recommandations. Les intérêts concurrents étaient évalués par l’intermédiaire d’une divulgation annuelle par courriel (annexe 2, Modèle de divulgation annuelle des conflits d’intérêts, p. 12) au comité de surveillance des conflits d’intérêts et par des mises à jour verbales, le cas échéant, aux présidents et présidents respectifs des groupes de travail à chacune des réunions.
Les Instituts de recherche en santé du Canada (programme de Subventions de planification et dissémination 2017) et Ostéoporose Canada ont assuré le financement de l’exercice. Organisation axée sur la patientèle, Ostéoporose Canada agit aux niveaux personnel, communautaire et gouvernemental par ses efforts de soutien, de formation et de promotion relatifs à la santé osseuse, à la réduction du risque de fracture et aux stratégies de prise en charge de l’ostéoporose. Elle reçoit environ 8 % de son financement de la part d’entreprises et de fondations (notamment du secteur pharmaceutique et de groupes d’intérêt) et le reste de sources gouvernementales (68,5 %), de particuliers (23 %) et d’autres groupes (0,5 %) (https://osteoporosecanada.ca/notre-impact/).
Nous avons assuré la gestion des conflits d’intérêts des bailleurs de fonds en maintenant notre indépendance devant la direction et les membres du personnel d’Ostéoporose Canada, qui ne siégeaient à aucun des comités ou groupes de travail. Les bailleurs de fonds ne pouvaient communiquer directement avec l’un ou l’autre des membres du comité directeur ou des groupes de travail. Le point de vue des organismes subventionnaires n’a influé ni sur le processus ni sur le contenu des recommandations des présentes lignes directrices. Le financement a permis d’assurer le soutien des bibliothécaires de recherche par l’intermédiaire de Cochrane Canada et de la méthodologiste de GRADE à l’Université McMaster par des mécanismes prescrits par l’établissement.
Autres lignes directricesLes changements apportés aux lignes directrices de 2010 d’Ostéoporose Canada8 comprennent le recours à la méthode GRADE dans l’élaboration des recommandations, l’ajout de recommandations élargies sur l’activité physique et les types d’exercices à privilégier et des conseils sur les nutriments bénéfiques autres que le calcium et la vitamine D. Nous fournissons aussi des directives plus claires sur les seuils d’instauration du traitement, la durée du traitement et le monitorage.
Fondées sur les données probantes tirées d’une revue systématique d’ECR, les lignes directrices du Groupe d’étude canadien sur les soins de santé préventifs contiennent, dans leurs recommandations, une évaluation du risque — par un premier dépistage de prévention primaire des fractures de fragilisation chez les femmes âgées de 65 ans et plus par une première utilisation de l’outil FRAX sans DMO72. Il est déconseillé d’effectuer un dépistage chez les femmes plus jeunes et les hommes de tous les âges. Notons que les recommandations du Groupe d’étude canadien sur les soins de santé préventifs s’appliquent aux personnes vivant dans la collectivité qui ne prennent pas de médicaments antiostéoporotiques.
Le groupe de travail des services préventifs des États-Unis a recueilli des données probantes confirmant l’exactitude de la mesure de la DMO et des outils d’évaluation du risque de fracture pour déterminer le risque de fracture ostéoporotique, et a conclu que les traitements pharmacologiques permettaient de réduire les taux de fractures chez les femmes ménopausées73. L’organisme américain Bone Health and Osteoporosis Foundation adopte une approche de dépistage semblable à celle proposée dans la présente actualisation (c.-à-d., repérage des femmes ménopausées et des hommes âgés de 50 ans et plus ayant des antécédents de fracture ou des facteurs de risque clinique) et recommande la pharmacothérapie dès l’occurrence de l’une ou l’autre des situations suivantes : fracture de vertèbres ou de la hanche; fracture de l’humérus, du bassin ou de l’avant-bras distal avec perte de masse osseuse; score T de DMO ≤ −2,5; faible masse osseuse et probabilité de ≥ 3 % de fracture de la hanche sur 10 ans selon l’outil américain FRAX ou de ≥ 20 % d’une fracture ostéoporotique majeure74. Quant à l’organisme United Kingdom National Osteoporosis Guidelines Group, il utilise un processus de dépistage en 2 temps pour repérer les personnes présentant un risque élevé de fracture, qui comprend des seuils d’intervention pharmacologique liés à l’âge75. Dans la plupart des lignes directrices cliniques, il est recommandé de procéder à l’évaluation du risque de fracture vertébrale chez les personnes ayant des facteurs de risque particuliers74,76.
Des lignes directrices récentes, comme celles du Collège des médecins des États-Unis, de la Bone Health and Osteoporosis Foundation et de l’United Kingdom National Osteoporosis Guidelines Group, contiennent des recommandations sur la prise de bisphosphonates en traitement de première intention chez les femmes ménopausées et les hommes atteints d’ostéoporose; le dénosumab et les médicaments anabolisants sont principalement suggérés en traitement de deuxième intention chez les personnes ayant des intolérances ou des contre-indications ou présentant un risque élevé de fracture44,74,75,77. De plus, on recommande, dans ces lignes directrices, un apport adéquat en calcium et en vitamine D et de l’activité physique pour réduire les chutes et le nombre de fractures.
Comments (0)